2025-04-23 13:33:17槑槑游戏园
本站 4 月 23 日消息,上皮细胞层是人体抵御外界感染的第一道防线,在维持身体正常状态、保护屏障和抵抗感染的过程中,其形状和结构会不断发生变化。
研究发现,细菌能够通过识别器官组织的几何特性以破坏细胞层的保护作用并引发感染扩散。组织器官几何特性调控细菌感染的具体机制对开发新型抗感染疗法意义重大,但这一科学问题尚未得到充分揭示。
4 月 21 日,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室研究员黄术强团队与中国农业大学教授朱奎团队、北京大学研究员黄建永团队合作,在国际学术期刊《细胞》发表最新研究:团队通过跨学科协同创新,从“器官几何结构特征-细胞力信号转导-病原菌感染”互作机制出发,首次揭示组织形态特征调控细菌感染的新规律。
同时团队提出了基于力敏感离子通道蛋白 Piezo1 的抗菌策略,为抗菌药物提质增效、降低毒副作用和指导合理用药提供了潜在方案,具有重要的临床应用前景。

力学导航揭秘细菌“精准打击”
研究团队通过结合微生物学、力学生物学与生物医学工程等多学科交叉研究发现,细菌感染并非随机发生,而是受到宿主组织力学特性的精准调控。
通过构建不同组织形态的上皮细胞层模型,探究病原菌与其互作的时空动态过程,团队揭示了多种病原菌在上皮单层中的空间感染规律并非传统认为的随机分布,而是呈现出明显的“边际效应”。
这种感染模式与细胞层的致密程度直接相关:结构越紧密的细胞层,其边缘区域越易被细菌侵袭,且这一规律不受细胞种类或培养条件影响。
该发现打破了细菌随机分布的传统认知,表明不同组织形态对细菌感染的空间分布具有重要调控作用。
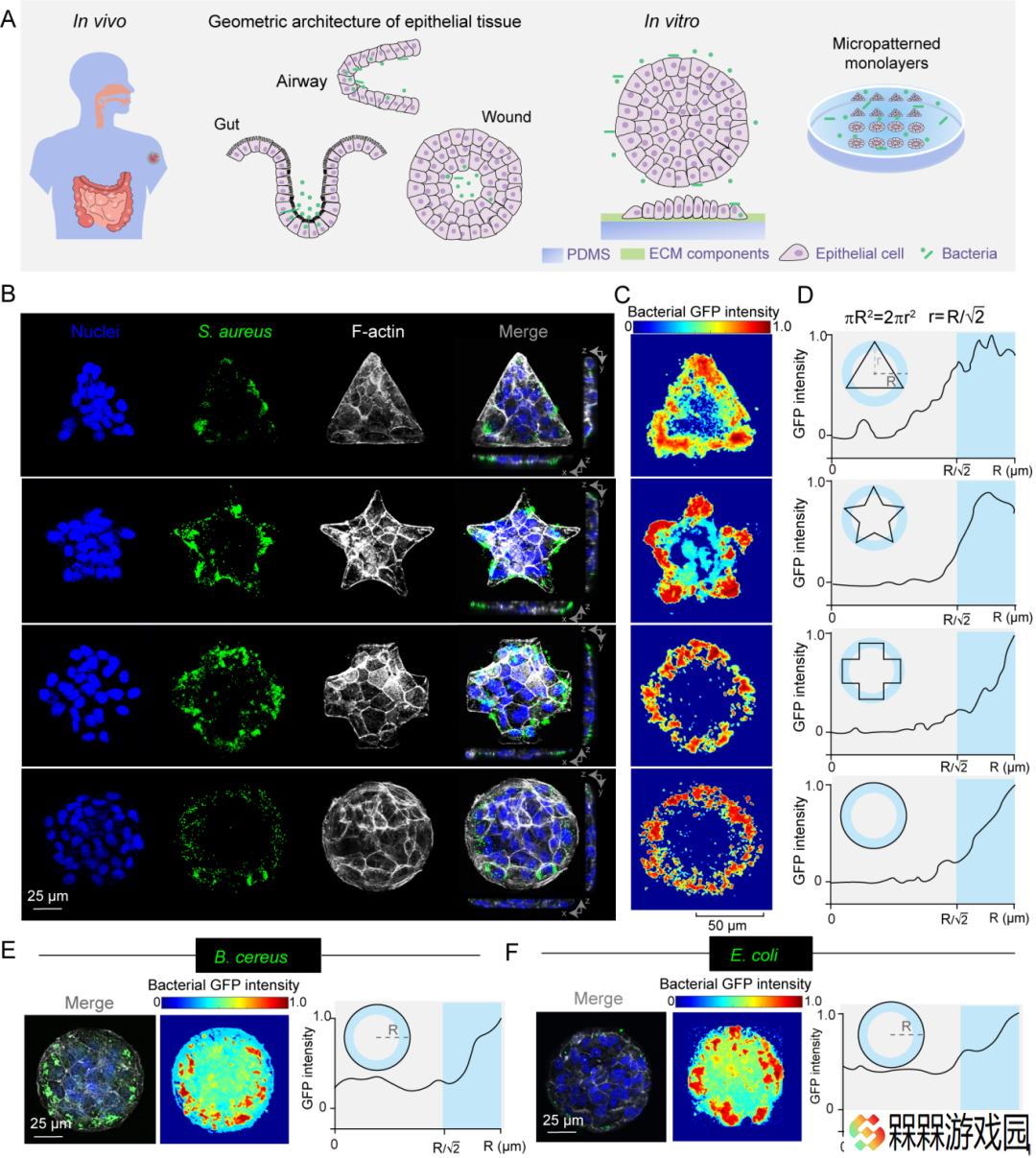
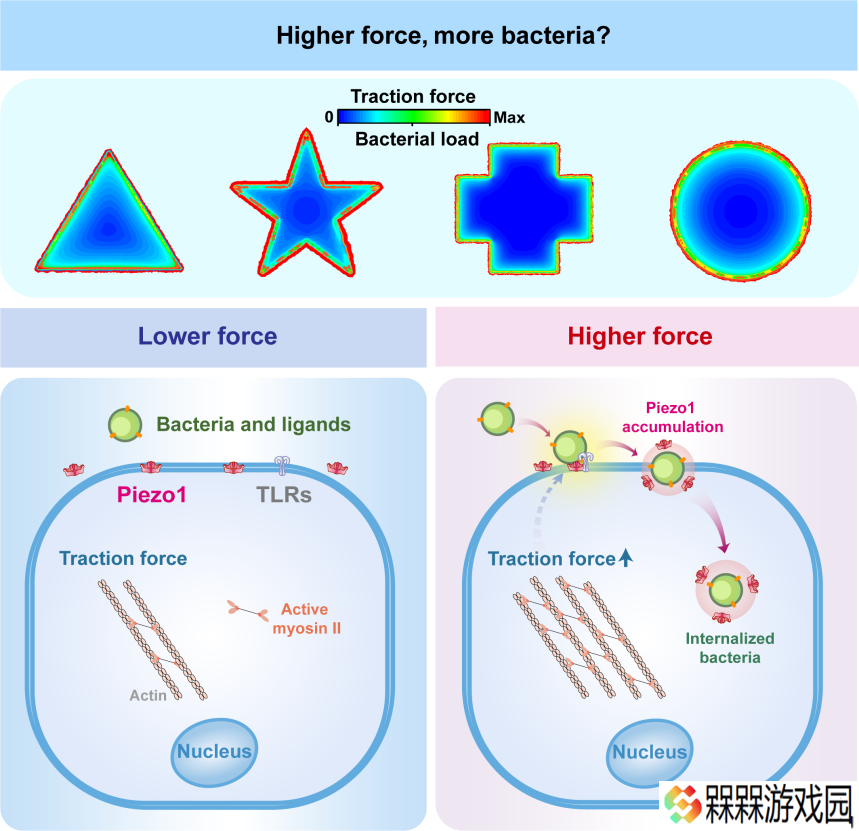
研究团队进一步通过力学分析模型发现,在上皮细胞层中,细胞牵引力与细菌感染具有高度协同性,高牵引力的细胞边缘区域更容易被细菌入侵。就像橡皮筋拉伸时两端受力最大,细胞层边缘因几何限制产生的“强拉力”,成为了细菌攻击的“热点区域”,这一发现为理解细菌感染的空间选择性提供了新的视角。
在此基础上,研究团队“锁定”了关键蛋白--力敏感性离子通道蛋白 Piezo1 的作用:当细菌开始入侵时,这种能感知牵引力的蛋白会像磁铁一样聚集到感染部位,形成特殊的囊泡结构。这些囊泡就像“信号放大器”,把细胞受到的牵引力转化为“生化信号”,促使更多细菌在边缘区域聚集感染。
这一发现不仅揭示了力学因素“指挥”细菌攻击位置的精细调控机制,还指出了一个全新治疗方向 —— 通过干扰细胞的力学感应系统(比如阻断 Piezo1 蛋白的功能),可能开发出阻止细菌精准定位感染部位的新型药物策略。
宿主导向抗菌新策略:精准给药破解肠道感染难题
研究团队基于以上“力学感应开关”--Piezo1 蛋白调控细菌感染的核心发现,创新性提出“力学导航抗菌”双效策略。
第一步靶向力学信号源头:尝试将 Piezo1 作为抗菌靶点,发现抑制 Piezo1 的表达和激活均能显著降低感染组织中的细菌载量。
第二步构建“仿生战场”:通过建立仿生 3D 肠道芯片精准复现肠道隐窝结构(类似肠道褶皱深处的隐蔽角落),发现消化道细菌倾向于在隐窝结构中富集,并在感染过程中隐匿在胞质中躲避抗菌制剂的杀伤作用,使传统药物难以有效渗透。
为此,团队开发了靶向隐窝结构的“细菌替身”纳米递药系统 —— 就像“特洛伊木马”般,这些纳米颗粒外壳模拟耐药菌的表面特征,内核装载抗生素。该药物递送系统不仅能够在物理空间上精准靶向感染位点、实现药物的空间精准递送,还能提升抗菌药物在隐窝结构的局部浓度,提高对耐药菌(如 MRSA 和 VRE)感染的疗效,这种“断其信号源 + 精准送弹药”的力学导航疗法,为应对耐药菌感染提供了增效减毒的新范式。
近年来抗生素研发的枯竭加剧了细菌耐药性对于公共卫生安全的威胁,亟需从多元角度开发新型的抗菌策略。传统的抗菌制剂研发过程通常仅关注对于细菌的杀伤效果,而该研究突破了传统“以菌为本”的研发思路,转向“宿主导向”的新模式。该治疗策略显著提升了抗生素抗消化道病原菌感染的疗效,不仅丰富了合理用药手段,更为应对全球耐药危机提供了创新解决方案。
本站附论文链接:
https://www.sciencedirect.com/science/article/abs/pii/S0092867425003940
声明:本文内容及配图由入驻作者撰写或者入驻合作网站授权转载。文章观点仅代表作者本人,不代表本站立场。文章及其配图仅供学习分享之
同类推荐更多

新品榜/热门榜